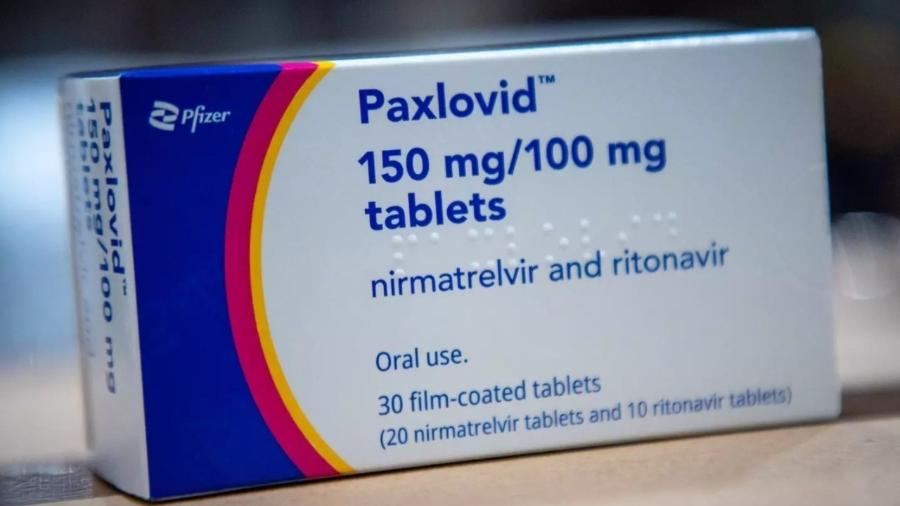
| A Pfizer deu início à comercialização do antiviral Paxlovid (nirmatrelvir + ritonavir), seu medicamento oral para o tratamento da COVID-19. A Agência Nacional de Vigilância Sanitária (ANVISA) aprovou em 21 de novembro de 2022, por unanimidade, a venda do antiviral em farmácias e hospitais particulares do País. O tratamento já está disponível para pacientes que apresentem prescrição médica. A venda no mercado privado é realizada pela SAR e 4bio, deliveries especializadas em fornecer medicamentos em todo território nacional, além de redes como Raia Drogasil, Venâncio, Panvel e Araujo. Paxlovid foi desenvolvido para ser administrado por via oral e o tratamento deve ser iniciado até cinco dias a partir do surgimento dos sintomas. Indicado para o tratamento da COVID-19 em adultos que não requerem oxigênio suplementar, ou seja, que apresentem as formas leve e moderada de COVID-19 e que tenham ao menos um fator de risco de progressão para quadro grave, o antiviral demonstrou em estudos clínicos que, em comparação com o placebo, reduz em até 89% a possibilidade de hospitalização ou morte em pacientes com as condições citadas. Entre os indivíduos que receberam a medicação durante os estudos clínicos, realizados com mais de 3500 participantes ao redor do mundo, não houve mortes. Paxlovid é um novo inibidor de protease desenvolvido pela Pfizer especificamente para bloquear a atividade da enzima 3LC, uma das responsáveis pela replicação do coronavírus. O medicamento demonstrou consistente atividade antiviral in vitro contra as principais variantes de preocupação identificadas (Alfa, Beta, Delta, Gama, Lambda, Um, além de Ômicron BA.1, BA.2. e BA.4). Com seu registro para uso emergencial aprovado em 30 de março de 2022 pela ANVISA, o medicamento já está disponível à população elegível pelo SUS desde outubro de 2022. O tratamento foi incorporado à rede pública para os seguintes grupos de pacientes, independentemente da condição vacinal: Imunossuprimidos a partir de18 anos e idosos com 65 anos ou mais de idade, que apresentem quadros leves a moderados, sem necessidade de suplementação de oxigênio. Para ter acesso ao medicamento pelo SUS, além de se enquadrar no perfil do público-alvo especificado pelo governo, o paciente deve ter um exame positivado (o que não inclui o autoteste) e a prescrição médica, que é realizada por meio de um formulário disponível no site do Ministério da Saúde. Com a documentação de liberação em mãos, o paciente pode ir a um posto indicado e retirar o tratamento. Todos os Estados do País já receberam a medicação, porém a Secretaria de Saúde de cada Estado tem independência para definir como será realizada a dispensação em sua localidade. Na maior parte dos casos, os tratamentos estão sendo disponibilizados por meio de UBS, Centros de Referência ou UPAs. Até o final de dezembro de 2022, o antiviral já foi disponibilizado a 60 países, com um total de 39 milhões de cursos de tratamento entregues globalmente*. |
Paxlovid, antiviral oral contra a COVID-19, começa a ser vendido
- 16/01/2023
- 16:07
- Saúde
- Ponto Final
Share on whatsapp
WhatsApp
Share on telegram
Telegram
Share on facebook
Facebook
Share on twitter
Twitter
Share on email
Email
O medicamento e indicado para adultos que não requerem oxigênio suplementar, ou seja, que apresentem as formas leve e moderada.